尿毒症毒素对脑血管和认知障碍的影响
发布时间:2019-03-06
脑血管疾病在慢性肾病患者中很常见,他们表现出认知障碍和痴呆的发病率增加,以及异常脑白质疾病的负担。在肾病患者中,短暂性脑缺血发作和中风的风险随着肾功能的逐步下降而增加。除高血压、糖尿病、炎症、血脂异常等传统心血管危险因素外,与肾损伤相关的非传统危险因素也可能使慢性肾病患者易患脑血管疾病。这些非传统的危险因素包括与CKD相关的骨矿物质代谢紊乱(CKD-MBD)、炎症和氧化应激。
蛋白结合尿毒症毒素(PBUTs),如吲哚硫酸酯(IS)或对甲酚硫酸酯(PCS),是氧化应激的强诱导剂。IS、PCS和胍类化合物在尿毒症患者的大脑中高度表达。这些高浓度的毒素(慢性肾病患者比健康组高10倍)存在于大脑中对认知起决定作用的区域,如丘脑、乳腺体和大脑皮层。推测PBUTs诱导的脑区氧化应激可能直接影响局部微循环和脑内细胞,从而导致CKD患者认知障碍和中风恢复不良。
本文综述了UTs诱导氧化应激可能促进大血管和微血管功能障碍的机制以及其对浸润巨噬细胞、小胶质细胞、星形胶质细胞和神经元的作用加重脑损伤。
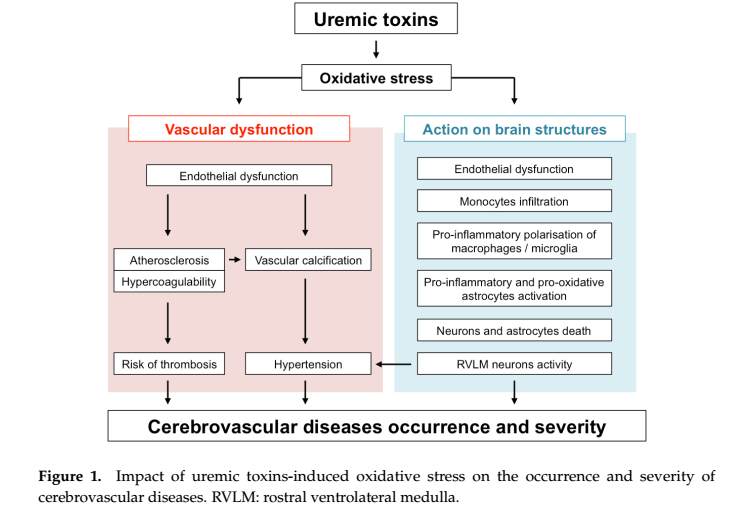
一、尿毒症毒素对大血管功能的影响
1. 血压调节
高血压是中风的主要危险因素。延髓腹外侧头端区(RVLM)神经元与尿酸、IS和甲基胍的过度融合增加了它们的活性,表明UTs诱导的氧化应激在延髓RVLM神经元的激活中起着关键作用。UTs产生的ROS可能通过激活RVLM神经元引起高血压。尿毒症患者接受血液透析显示含有高浓度的硫氨基酸衍生物羊毛硫氨酸。在尿毒症患者中,胱硫醚合成酶(CBS)和胱硫醚裂合酶(CSE)水平均升高,以半胱氨酸和同型半胱氨酸为底物产生硫化氢。羊毛硫氨酸被认为是硫化氢(H2S)代谢的稳定产物。近年来,硫化氢被认为是除一氧化氮(NO)和一氧化碳(CO)的第三种重要的内源性血管扩张剂气体信号因子。研究发现暴露于硫化氢可增强大鼠主动脉中由NO引起的平滑肌松弛,这表明内源性硫化氢可与NO协同调节平滑肌张力。
2. 血管功能障碍
UTs对血管系统的作用可能导致神经系统功能紊乱。例如,UTs诱导的氧化应激加速动脉粥样硬化和内皮功能障碍的进展,两者都与痴呆和中风的风险增加有关。无机磷酸盐(PI)、IS、TNF-α、IL-6和晚期糖基化终产物可促进颅内血管钙化的发展,至少部分是由氧化应激增加引起的。这种现象加重了动脉硬化、并导致高血压的发生,而高血压是中风的主要危险因素。
3. 止血
与IS水平相关的参数(血管性血友病因子、可溶性尿激酶型纤溶酶原激活受体、可溶性细胞间粘附分子-1)与慢性肾病患者心血管疾病的患病率呈正相关,这是通过改变单核细胞活化、强化炎症过程和增加氧化应激所致。高同型半胱氨酸血症在慢性肾病患者中常见,对血管系统有直接的凝血酶原作用,因此可能导致大血管和小血管疾病。同型半胱氨酸是一种含硫醇的氨基酸,来源于膳食蛋氨酸的代谢。血浆同型半胱氨酸水平中度升高是动脉和静脉血栓形成的重要独立危险因素。高同型半胱氨酸血症与关键凝血蛋白纤维蛋白原的异常有关。可能通过干扰血管内血栓清除的正常过程而直接促进血栓形成。叶酸缺乏是高同型半胱氨酸血症的可治疗因素。中国脑卒中一级预防试验证实了同型半胱氨酸诱导的血栓形成在脑血管疾病发病中的潜在作用,叶酸作为降低同型半胱氨酸血症和预防中国高血压成人脑卒中的一种手段有一定的获益。与认知障碍有关的胍类化合物和羊毛硫氨酸对胱硫醚合成酶(CBS)的抑制可诱导血清同型半胱氨酸升高。
4. 心房颤动
慢性肾脏病与房颤的高发病率有关,这增加了血栓栓塞性卒中、心力衰竭和死亡率的风险。IS刺激了THP-1细胞中TNF-α、IL-6和IL-1的mRNA表达,证明具有促纤维化、促肥厚和促炎作用,加上先前讨论过的血栓形成特性,可能增加CKD患者心房纤维化的发生率和随后的卒中发生率。
二、尿毒症毒素对脑微循环的影响
1. 内皮细胞
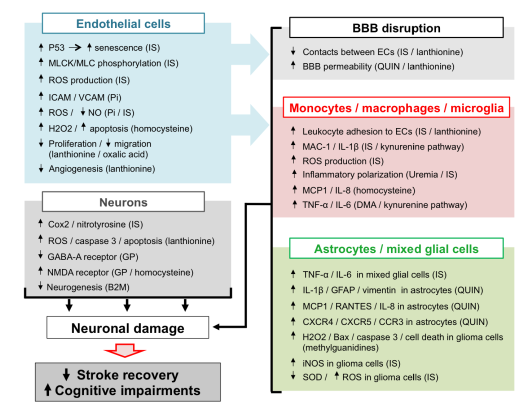
小血管疾病(SVD)是一种全身性疾病,对认知障碍的主要影响已得到明确认识。UTs是大血管内皮功能障碍的强诱导剂,肾脏疾病患者也容易发生外周微血管功能障碍,可以通过增加ROS的产生,在大血管和脑微血管中诱发内皮功能障碍,可能直接促进SVD,进而导致中风和认知障碍。85%的透析患者的同型半胱氨酸水平升高,为痴呆症的独立危险因素,增加阿尔茨海默病的患病风险。高水平的总同型半胱氨酸与白质高强度体积有关,这表明同型半胱氨酸是白质损害的危险因素。UTs可直接改变大血管和小血管内皮细胞的完整性。磷酸盐可能通过增加脑内皮细胞中VCAM-1和ICAM-1的表达而引起局部炎症,从而导致慢性肾病患者的神经炎症疾病。IS可诱导白细胞粘附在血管壁上,促进大血管内皮细胞的衰老,引起肺动脉内皮细胞之间的接触中断。尿毒症大血管内皮细胞的复制和迁移的抑制水平对草酸浓度和时间存在依赖性。同型半胱氨酸通过增加H2O2的产生,影响抗氧化防御系统,并通过线粒体氧化剂的产生诱导细胞凋亡,从而损害内皮细胞。血管生成被认为是一种天然的防御机制,有助于恢复缺血脑组织的氧气和营养供应。缺血性边界的微血管密度越大,卒中患者的生存期越长。血管内皮生长因子(VEGF)可促进血管生成并增强缺血区域的血流。硫化氢对体外培养的内皮细胞增殖和迁移有刺激作用,通过释放缺氧平滑肌细胞中的血管内皮生长因子间接诱导血管生成。羊毛硫氨酸诱导的硫化氢生成受损可能与中风后功能恢复不佳有关。
2. 单核细胞/巨噬细胞
慢性肾病患者炎症增强,炎症标志物与终末期肾病发病率和死亡率增加相关。在透析患者中,C反应蛋白(CRP)可预测中风和死亡。IS和PC具有促炎作用,其血清浓度与慢性肾病患者的炎症标志物相关。其中一些炎症标志物,如肿瘤坏死因子、白细胞介素6和白细胞介素1,目前被认为是UTs。IL-1α、IL-1β和TNF-α参与神经炎症的发生,而其他介体,包括IL-1、6、10、17、20和TNF-a,再次参与神经炎症的恶化。相反,TGF-β、IL-10、17和23等有助于神经炎症的缓解。由UTs引起的炎症,如IS、对称二甲基精氨酸(SDMA)、胍基化合物或喹啉酸(QUIN),可能会增加慢性肾病患者中风和认知障碍的风险。IS使单核细胞向低炎性、有益的巨噬细胞分化,因此可能有助于慢性炎症的持续。脑出血BBB破裂后脑内单核细胞的恢复在很大程度上导致了脑炎症的增加和随后缺血性病变的加重。血清中高水平的二甲基精氨酸(DMA)(对称和不对称)与更严重的中风和有害的中风结局相关。SDMA水平与慢性肾病患者的炎症标志物CRP相关,诱导炎症和白细胞活化可导致尿毒症患者的心血管并发症。胍类化合物对炎症有双重作用,甲基胍和胍乙酸增加单核细胞的TNF-α生成,而胍基琥珀酸对单核细胞的TNF-a生成有抑制作用。在炎症过程中,KYN途径可被细胞因子,特别是IFN-γ激活,导致单核细胞产生蛋白结合型尿毒症兴奋毒素QUIN。QUIN神经毒性已被证明与神经炎症(包括阿尔茨海默病)相关的神经退行性过程的发病机制有关。硫化氢是急性炎症的重要抑制剂,可诱导中性粒细胞凋亡,从而有助于炎症反应的抑制。高循环水平的β2-微球蛋白(B2M)增加缺血性卒中风险,与血液透析患者的CRP、TNF、IL-6和心血管危险因素相关,因此可能通过作用于炎症而增加中风风险。
三、尿毒症毒素对脑细胞的影响
肾损害与脑脊液和脑组织中的UTs积聚有关。UTs在脑结构中的积累被认为与它们在血脑屏障和血脑脊髓液屏障(BCSFB)处的转运体表达有关。UTs渗透到大脑结构中可能会对脑内细胞(如小胶质细胞、星形胶质细胞和神经元)产生有害影响。
1. 小胶质细胞
IS促进巨噬细胞向M1表型极化,它们也可能同时促进驻留小胶质细胞向促炎表型极化。犬尿氨酸途径代谢平衡最近被报道影响小胶质细胞的活性。
2. 星形细胞
在健康的神经组织中,星形胶质细胞在能量供应、血流调节、细胞外液、离子和递质的稳态、突触功能的调节和突触重构中起着关键作用。星形细胞变性存在抑郁症或痴呆等病理状况。痴呆是一种神经疾病,在尿毒症患者中比一般人群中更常见,并且有几种类型的痴呆与星形胶质细胞凋亡有关。甲基胍通过增强H2O2的促凋亡作用和改变胶质细胞中线粒体钙稳态,促进尿毒症相关的神经变性。氧化应激也会通过导致神经胶质细胞死亡影响中风后的神经恢复。中风后发生的炎症反应会逐渐引起星形胶质细胞增生,IS诱导的氧化应激和随后的星形胶质细胞增生产生了一个神经毒性环境。喹啉酸可增加人星形胶质细胞中IL-1的产生,可能在慢性肾病脑炎症的放大中起关键作用。
3. 神经元
ROS积累导致神经元损伤并引发细胞凋亡。UTs也可能通过氧化应激增加引起的直接神经毒性作用引起认知功能障碍或损害中风后恢复。胍类化合物通过阻断GABA-A和激活谷氨酸N-甲基-D-天冬氨酸(NMDA)受体发挥直接的神经毒性作用。同型半胱氨酸不仅可能与导致中风的血管损伤有关,而且可能参与随后的大脑神经毒性反应。β2-微球蛋白的积累会促进认知功能障碍和神经障碍。硫化氢参与缺血再灌注损伤和休克的病理生理过程,对神经元具有保护作用;羊毛硫氨酸诱导的硫化氢生成受损可能在慢性肾病相关脑血管疾病的发病和恶化中起着核心作用。
四、结论
在慢性肾病患者中,UTs的积累导致了外周血管功能障碍(内皮功能障碍、动脉粥样硬化、血管钙化、RVLM神经元过度激活引起的高血压),从而改变了一般的血流动力学,促进了脑血管疾病的发生。此外,UTs可能在大脑微环境中显示出直接的有害作用。主要机制是Pi和IS引起的内皮功能障碍可能导致血脑屏障破坏和白细胞粘附,导致白细胞向受损大脑的渗透增加,随后巨噬细胞和星形胶质细胞暴露于UTs会放大炎症细胞因子的释放和大脑微环境中的氧化应激,加上某些UTs的直接神经毒性,促进神经元凋亡。总之,这些机制可能解释了慢性肾病患者认知功能加速下降和中风预后不良的原因。
文献来源:Maryam Assem, Mathilde Lando, Maria Grissi, et. The Impact of Uremic Toxins on Cerebrovascular and Cognitive Disorders[J]. Toxins,2018,10,303.
脑血管疾病在慢性肾病患者中很常见,他们表现出认知障碍和痴呆的发病率增加,以及异常脑白质疾病的负担。在肾病患者中,短暂性脑缺血发作和中风的风险随着肾功能的逐步下降而增加。除高血压、糖尿病、炎症、血脂异常等传统心血管危险因素外,与肾损伤相关的非传统危险因素也可能使慢性肾病患者易患脑血管疾病。这些非传统的危险因素包括与CKD相关的骨矿物质代谢紊乱(CKD-MBD)、炎症和氧化应激。
蛋白结合尿毒症毒素(PBUTs),如吲哚硫酸酯(IS)或对甲酚硫酸酯(PCS),是氧化应激的强诱导剂。IS、PCS和胍类化合物在尿毒症患者的大脑中高度表达。这些高浓度的毒素(慢性肾病患者比健康组高10倍)存在于大脑中对认知起决定作用的区域,如丘脑、乳腺体和大脑皮层。推测PBUTs诱导的脑区氧化应激可能直接影响局部微循环和脑内细胞,从而导致CKD患者认知障碍和中风恢复不良。
本文综述了UTs诱导氧化应激可能促进大血管和微血管功能障碍的机制以及其对浸润巨噬细胞、小胶质细胞、星形胶质细胞和神经元的作用加重脑损伤。

一、尿毒症毒素对大血管功能的影响
1. 血压调节
高血压是中风的主要危险因素。延髓腹外侧头端区(RVLM)神经元与尿酸、IS和甲基胍的过度融合增加了它们的活性,表明UTs诱导的氧化应激在延髓RVLM神经元的激活中起着关键作用。UTs产生的ROS可能通过激活RVLM神经元引起高血压。尿毒症患者接受血液透析显示含有高浓度的硫氨基酸衍生物羊毛硫氨酸。在尿毒症患者中,胱硫醚合成酶(CBS)和胱硫醚裂合酶(CSE)水平均升高,以半胱氨酸和同型半胱氨酸为底物产生硫化氢。羊毛硫氨酸被认为是硫化氢(H2S)代谢的稳定产物。近年来,硫化氢被认为是除一氧化氮(NO)和一氧化碳(CO)的第三种重要的内源性血管扩张剂气体信号因子。研究发现暴露于硫化氢可增强大鼠主动脉中由NO引起的平滑肌松弛,这表明内源性硫化氢可与NO协同调节平滑肌张力。
2. 血管功能障碍
UTs对血管系统的作用可能导致神经系统功能紊乱。例如,UTs诱导的氧化应激加速动脉粥样硬化和内皮功能障碍的进展,两者都与痴呆和中风的风险增加有关。无机磷酸盐(PI)、IS、TNF-α、IL-6和晚期糖基化终产物可促进颅内血管钙化的发展,至少部分是由氧化应激增加引起的。这种现象加重了动脉硬化、并导致高血压的发生,而高血压是中风的主要危险因素。
3. 止血
与IS水平相关的参数(血管性血友病因子、可溶性尿激酶型纤溶酶原激活受体、可溶性细胞间粘附分子-1)与慢性肾病患者心血管疾病的患病率呈正相关,这是通过改变单核细胞活化、强化炎症过程和增加氧化应激所致。高同型半胱氨酸血症在慢性肾病患者中常见,对血管系统有直接的凝血酶原作用,因此可能导致大血管和小血管疾病。同型半胱氨酸是一种含硫醇的氨基酸,来源于膳食蛋氨酸的代谢。血浆同型半胱氨酸水平中度升高是动脉和静脉血栓形成的重要独立危险因素。高同型半胱氨酸血症与关键凝血蛋白纤维蛋白原的异常有关。可能通过干扰血管内血栓清除的正常过程而直接促进血栓形成。叶酸缺乏是高同型半胱氨酸血症的可治疗因素。中国脑卒中一级预防试验证实了同型半胱氨酸诱导的血栓形成在脑血管疾病发病中的潜在作用,叶酸作为降低同型半胱氨酸血症和预防中国高血压成人脑卒中的一种手段有一定的获益。与认知障碍有关的胍类化合物和羊毛硫氨酸对胱硫醚合成酶(CBS)的抑制可诱导血清同型半胱氨酸升高。
4. 心房颤动
慢性肾脏病与房颤的高发病率有关,这增加了血栓栓塞性卒中、心力衰竭和死亡率的风险。IS刺激了THP-1细胞中TNF-α、IL-6和IL-1的mRNA表达,证明具有促纤维化、促肥厚和促炎作用,加上先前讨论过的血栓形成特性,可能增加CKD患者心房纤维化的发生率和随后的卒中发生率。
二、尿毒症毒素对脑微循环的影响
1. 内皮细胞
小血管疾病(SVD)是一种全身性疾病,对认知障碍的主要影响已得到明确认识。UTs是大血管内皮功能障碍的强诱导剂,肾脏疾病患者也容易发生外周微血管功能障碍,可以通过增加ROS的产生,在大血管和脑微血管中诱发内皮功能障碍,可能直接促进SVD,进而导致中风和认知障碍。85%的透析患者的同型半胱氨酸水平升高,为痴呆症的独立危险因素,增加阿尔茨海默病的患病风险。高水平的总同型半胱氨酸与白质高强度体积有关,这表明同型半胱氨酸是白质损害的危险因素。UTs可直接改变大血管和小血管内皮细胞的完整性。磷酸盐可能通过增加脑内皮细胞中VCAM-1和ICAM-1的表达而引起局部炎症,从而导致慢性肾病患者的神经炎症疾病。IS可诱导白细胞粘附在血管壁上,促进大血管内皮细胞的衰老,引起肺动脉内皮细胞之间的接触中断。尿毒症大血管内皮细胞的复制和迁移的抑制水平对草酸浓度和时间存在依赖性。同型半胱氨酸通过增加H2O2的产生,影响抗氧化防御系统,并通过线粒体氧化剂的产生诱导细胞凋亡,从而损害内皮细胞。血管生成被认为是一种天然的防御机制,有助于恢复缺血脑组织的氧气和营养供应。缺血性边界的微血管密度越大,卒中患者的生存期越长。血管内皮生长因子(VEGF)可促进血管生成并增强缺血区域的血流。硫化氢对体外培养的内皮细胞增殖和迁移有刺激作用,通过释放缺氧平滑肌细胞中的血管内皮生长因子间接诱导血管生成。羊毛硫氨酸诱导的硫化氢生成受损可能与中风后功能恢复不佳有关。
2. 单核细胞/巨噬细胞
慢性肾病患者炎症增强,炎症标志物与终末期肾病发病率和死亡率增加相关。在透析患者中,C反应蛋白(CRP)可预测中风和死亡。IS和PC具有促炎作用,其血清浓度与慢性肾病患者的炎症标志物相关。其中一些炎症标志物,如肿瘤坏死因子、白细胞介素6和白细胞介素1,目前被认为是UTs。IL-1α、IL-1β和TNF-α参与神经炎症的发生,而其他介体,包括IL-1、6、10、17、20和TNF-a,再次参与神经炎症的恶化。相反,TGF-β、IL-10、17和23等有助于神经炎症的缓解。由UTs引起的炎症,如IS、对称二甲基精氨酸(SDMA)、胍基化合物或喹啉酸(QUIN),可能会增加慢性肾病患者中风和认知障碍的风险。IS使单核细胞向低炎性、有益的巨噬细胞分化,因此可能有助于慢性炎症的持续。脑出血BBB破裂后脑内单核细胞的恢复在很大程度上导致了脑炎症的增加和随后缺血性病变的加重。血清中高水平的二甲基精氨酸(DMA)(对称和不对称)与更严重的中风和有害的中风结局相关。SDMA水平与慢性肾病患者的炎症标志物CRP相关,诱导炎症和白细胞活化可导致尿毒症患者的心血管并发症。胍类化合物对炎症有双重作用,甲基胍和胍乙酸增加单核细胞的TNF-α生成,而胍基琥珀酸对单核细胞的TNF-a生成有抑制作用。在炎症过程中,KYN途径可被细胞因子,特别是IFN-γ激活,导致单核细胞产生蛋白结合型尿毒症兴奋毒素QUIN。QUIN神经毒性已被证明与神经炎症(包括阿尔茨海默病)相关的神经退行性过程的发病机制有关。硫化氢是急性炎症的重要抑制剂,可诱导中性粒细胞凋亡,从而有助于炎症反应的抑制。高循环水平的β2-微球蛋白(B2M)增加缺血性卒中风险,与血液透析患者的CRP、TNF、IL-6和心血管危险因素相关,因此可能通过作用于炎症而增加中风风险。
三、尿毒症毒素对脑细胞的影响
肾损害与脑脊液和脑组织中的UTs积聚有关。UTs在脑结构中的积累被认为与它们在血脑屏障和血脑脊髓液屏障(BCSFB)处的转运体表达有关。UTs渗透到大脑结构中可能会对脑内细胞(如小胶质细胞、星形胶质细胞和神经元)产生有害影响。
1. 小胶质细胞
IS促进巨噬细胞向M1表型极化,它们也可能同时促进驻留小胶质细胞向促炎表型极化。犬尿氨酸途径代谢平衡最近被报道影响小胶质细胞的活性。
2. 星形细胞
在健康的神经组织中,星形胶质细胞在能量供应、血流调节、细胞外液、离子和递质的稳态、突触功能的调节和突触重构中起着关键作用。星形细胞变性存在抑郁症或痴呆等病理状况。痴呆是一种神经疾病,在尿毒症患者中比一般人群中更常见,并且有几种类型的痴呆与星形胶质细胞凋亡有关。甲基胍通过增强H2O2的促凋亡作用和改变胶质细胞中线粒体钙稳态,促进尿毒症相关的神经变性。氧化应激也会通过导致神经胶质细胞死亡影响中风后的神经恢复。中风后发生的炎症反应会逐渐引起星形胶质细胞增生,IS诱导的氧化应激和随后的星形胶质细胞增生产生了一个神经毒性环境。喹啉酸可增加人星形胶质细胞中IL-1的产生,可能在慢性肾病脑炎症的放大中起关键作用。
3. 神经元
ROS积累导致神经元损伤并引发细胞凋亡。UTs也可能通过氧化应激增加引起的直接神经毒性作用引起认知功能障碍或损害中风后恢复。胍类化合物通过阻断GABA-A和激活谷氨酸N-甲基-D-天冬氨酸(NMDA)受体发挥直接的神经毒性作用。同型半胱氨酸不仅可能与导致中风的血管损伤有关,而且可能参与随后的大脑神经毒性反应。β2-微球蛋白的积累会促进认知功能障碍和神经障碍。硫化氢参与缺血再灌注损伤和休克的病理生理过程,对神经元具有保护作用;羊毛硫氨酸诱导的硫化氢生成受损可能在慢性肾病相关脑血管疾病的发病和恶化中起着核心作用。
四、结论
在慢性肾病患者中,UTs的积累导致了外周血管功能障碍(内皮功能障碍、动脉粥样硬化、血管钙化、RVLM神经元过度激活引起的高血压),从而改变了一般的血流动力学,促进了脑血管疾病的发生。此外,UTs可能在大脑微环境中显示出直接的有害作用。主要机制是Pi和IS引起的内皮功能障碍可能导致血脑屏障破坏和白细胞粘附,导致白细胞向受损大脑的渗透增加,随后巨噬细胞和星形胶质细胞暴露于UTs会放大炎症细胞因子的释放和大脑微环境中的氧化应激,加上某些UTs的直接神经毒性,促进神经元凋亡。总之,这些机制可能解释了慢性肾病患者认知功能加速下降和中风预后不良的原因。

文献来源:Maryam Assem, Mathilde Lando, Maria Grissi, et. The Impact of Uremic Toxins on Cerebrovascular and Cognitive Disorders[J]. Toxins,2018,10,303.




